


Next: OBJECTIF DE LA THESE
Up: La génétique du psoriasis
Previous: PSORS5
Contents
La disponibilité de modèles animaux de maladies humaines, obtenus naturellement ou par ingénierie génétique en sur-exprimant dans des souris transgéniques, une protéine ou au contraire en détruisant le gène avec déficience de la protéine correspondante permet de mieux comprendre les mécanismes biologiques impliqués et le rôle éventuel de la protéine impliquée dans la physiopathologie de la maladie. La reproduction des symptômes de la maladie dans ces modèles permet aussi de tester les traitements susceptibles de soigner la maladie chez l'homme.
Aucun modèle animal naturel n'existe pour le psoriasis. Il existe néanmoins des mutations spontanées à l'état homozygote (Ttc7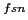 , cpdm, Scd1
, cpdm, Scd1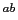 ) chez quelques souris qui entraînent des lésions dites psoriasiformes comme l'hyperprolifération épidermique, l'infiltration par des macrophages et des changements vasculaires. Cependant, ces souris ne montrent pas toutes les caractéristiques pathologiques du psoriasis comme la présence d'infiltration de lymphocytes T ainsi qu'une réponse aux traitements anti-psoriasis comme la cyclosporine et le calcipotriol [Gudjonsson et al., 2007].
) chez quelques souris qui entraînent des lésions dites psoriasiformes comme l'hyperprolifération épidermique, l'infiltration par des macrophages et des changements vasculaires. Cependant, ces souris ne montrent pas toutes les caractéristiques pathologiques du psoriasis comme la présence d'infiltration de lymphocytes T ainsi qu'une réponse aux traitements anti-psoriasis comme la cyclosporine et le calcipotriol [Gudjonsson et al., 2007].
Plusieurs modèles murins pour le psoriasis ont été développés, malgré des différences entre la peau et l'immunité humaine et murine (dont l'épaisseur et le nombre des couches de la peau). La plupart de ces modèles sur-exprime ou n'exprime plus des gènes dont l'expression semble être altérée dans le psoriasis tels que les cytokines (IL-20, IL-6, IL-1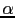 , IL-1ra) ou des facteurs de croissance (TGF-
, IL-1ra) ou des facteurs de croissance (TGF-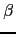 1, VEGF). Ces changements d'expression sont ciblés au niveau de la couche basale de l'épiderme grâce à l'utilisation de promoteurs des gènes de kératine KRT5 ou KRT14 ou au niveau de la couche suprabasale grâce aux promoteurs des gènes KRT1, KRT10 ou de l'involucrine. L'ensemble des caractéristiques des modèles murins et leurs similarités avec le psoriasis humain sont détaillés dans le tableau 1.12Modèles murins et leur ressemblance au psoriasis humain.
1, VEGF). Ces changements d'expression sont ciblés au niveau de la couche basale de l'épiderme grâce à l'utilisation de promoteurs des gènes de kératine KRT5 ou KRT14 ou au niveau de la couche suprabasale grâce aux promoteurs des gènes KRT1, KRT10 ou de l'involucrine. L'ensemble des caractéristiques des modèles murins et leurs similarités avec le psoriasis humain sont détaillés dans le tableau 1.12Modèles murins et leur ressemblance au psoriasis humain.
Les modèles murins semblent indiquer l'importance de la voie de Stat3, de NF-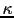 B, du facteur de transcription AP-1, des intégrines, des facteurs de croissance, des interleukines ainsi que des cellules T dans la survenue du psoriasis (Figure 1.15Trois voies de signalisation des modèles murins de psoriasis: STAT3, AP-1 et NF-$$B).
B, du facteur de transcription AP-1, des intégrines, des facteurs de croissance, des interleukines ainsi que des cellules T dans la survenue du psoriasis (Figure 1.15Trois voies de signalisation des modèles murins de psoriasis: STAT3, AP-1 et NF-$$B).
Stat3 est un facteur de transcription intervenant, quand il est activé, dans de nombreux processus physiologiques comme la prolifération, la migration et la survie cellulaire. Il semble aussi jouer un rôle dans le psoriasis. Des observations
Table 1.12:
Modèles murins et leur ressemblance au psoriasis humain
La première ligne indique les changements caractéristiques du psoriasis chez l'Homme suivi de ceux chez des modèles murins (Xg: xénogreffe, Alg: allogreffe avec des CMH différents, et Sp: modèles murins spontanés, Y, oui; N; non). Les différences avec l'Homme sont indiquées en rouge, les ressemblances en vert et les données inconnues en jaune. Les nombreux modèles murins ont la plupart des caractéristiques du psoriasis, malgré les différences histologiques de la peau des deux mammifères. (D'après [Gudjonsson et al., 2007])
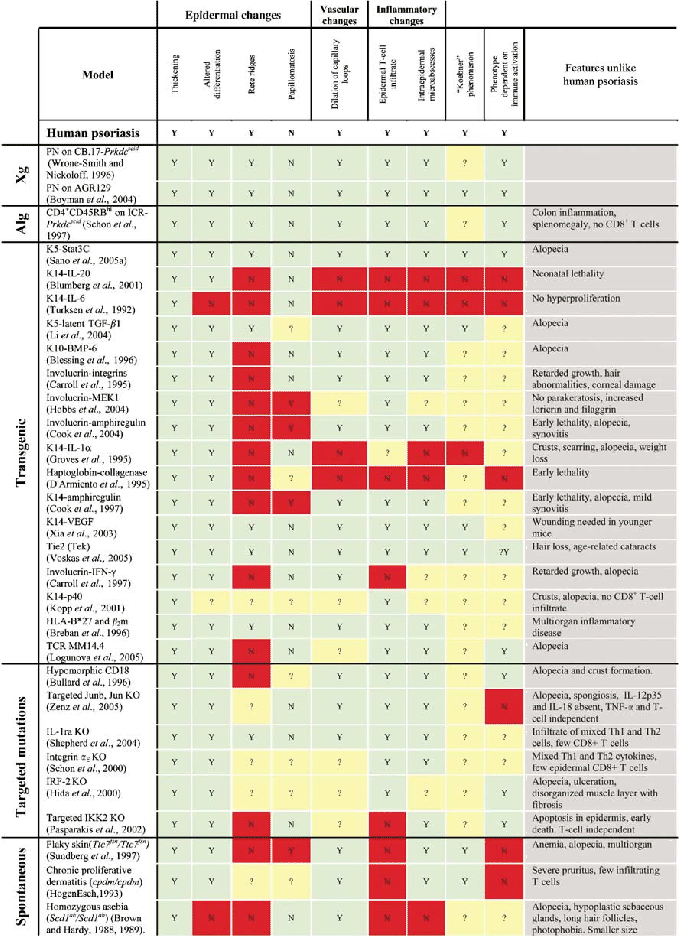 |
Figure 1.15:
Trois voies de signalisation des modèles murins de psoriasis: STAT3, AP-1 et NF-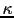 B
B
(a) Des signaux extracellulaires (IL-6, IL-20, etc) activent la voie STAT. Stat3 est activé par phosphorylation, suivi par sa dimérisation et sa translocation nucléaire. (b) Les protéines Jun (Jun, JunB, et JunD) avec d'autres protéines (Fos, ATF et CREB) sont les composants principaux de la famille du facteur de transcription AP-1. Jun intervient dans la prolifération cellulaire (via p53 et la cyclin D1), alors que JunB régule négativement la croissance cellulaire (via l'inhibiteur p16INK4a). (c) De nombreux signaux extracellulaires sont transmis au noyau via NF-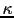 B sous le contrôle du complexe kinase IkB (IKK). Activé lors de la phosphorylation de ses sous-unités IKKa et IKKb, IKK phosphorylise IkB, entraînant sa dissociation, suivi de sa dégradation. Ceci amène à la libération de NF-
B sous le contrôle du complexe kinase IkB (IKK). Activé lors de la phosphorylation de ses sous-unités IKKa et IKKb, IKK phosphorylise IkB, entraînant sa dissociation, suivi de sa dégradation. Ceci amène à la libération de NF-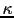 B actif (p50 and Rel-A(p65)) qui se transloque au noyau pour induire la transcription de gènes cibles.
(D'après [Gudjonsson et al., 2007])
B actif (p50 and Rel-A(p65)) qui se transloque au noyau pour induire la transcription de gènes cibles.
(D'après [Gudjonsson et al., 2007])
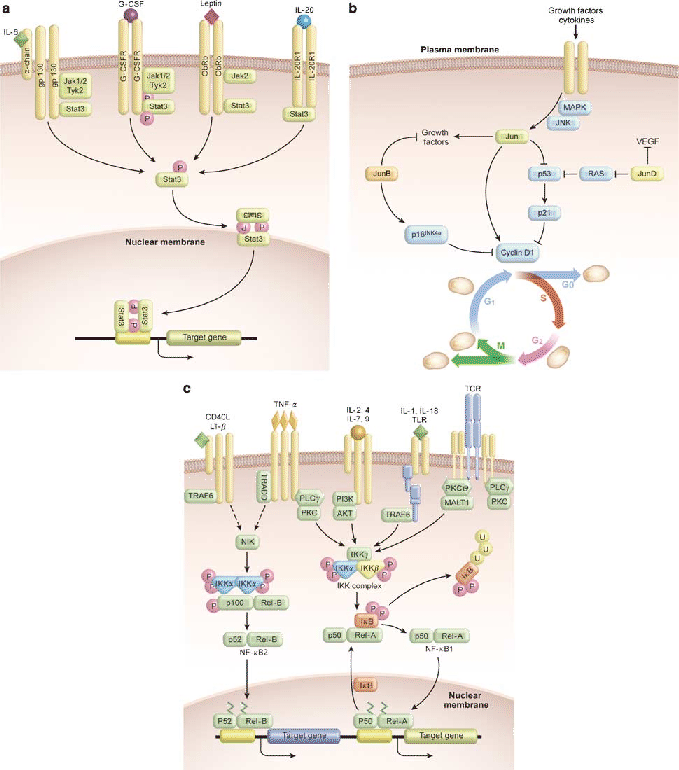 |
indiquent que Stat3 semble être un régulateur de la prolifération des kératinocytes et qu'il est présent sous forme activée au niveau des lésions psoriasiques humaines. Des lésions de la peau de type psoriasique ont d'ailleurs été obtenues spontanément ou en réponse à une blessure chez une souris transgénique exprimant de manière constitutive dans les kératinocytes basales Stat3 sous forme active. Cependant, le développement des lésions dans ce modèle semble être dépendant de l'activation des cellules T. D'autres souris transgéniques exprimant des activateurs potentiels de Stat3, montrés surexprimés dans la peau lésée, comme IL-20 et IL-6, montrent aussi des caractéristiques typiques du psoriasis telles que l'hyperprolifération des kératinocytes et une altération de la différenciation mais contrairement aux mutants Stat3, aucune infiltration par des leucocytes n'est observée.
Une autre voie semble intervenir dans la maladie: la voie NF-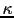 B. Cette voie de signalisation joue un rôle dans le contrôle de nombreux gènes impliqués dans le développement, dans la mort cellulaire programmée mais surtout dans la réponse immune et inflammatoire et dans la prolifération cellulaire. Les facteurs de transcription NF-
B. Cette voie de signalisation joue un rôle dans le contrôle de nombreux gènes impliqués dans le développement, dans la mort cellulaire programmée mais surtout dans la réponse immune et inflammatoire et dans la prolifération cellulaire. Les facteurs de transcription NF-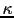 B sont maintenus à l'état inactif par leur association avec les protéines inhibitrices de la famille des I
B sont maintenus à l'état inactif par leur association avec les protéines inhibitrices de la famille des I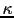 B qui inhibent en partie la translocation au noyau de NF-
B qui inhibent en partie la translocation au noyau de NF-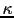 B et la capacité de liaison de NF-
B et la capacité de liaison de NF-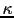 B à l'ADN. L'activation des dimères NF-
B à l'ADN. L'activation des dimères NF-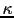 B est réalisée par le complexe I
B est réalisée par le complexe I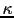 B kinase (IKK) qui est composé de deux sous-unités catalytiques IKK
B kinase (IKK) qui est composé de deux sous-unités catalytiques IKK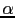 et IKK
et IKK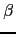 et d'une protéine régulatrice IKK
et d'une protéine régulatrice IKK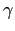 /NEMO. Lorsque IKK est activé, il phosphoryle I
/NEMO. Lorsque IKK est activé, il phosphoryle I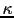 B qui conduit, lors de la fixation d'un complexe, à la polyubiquitination de I
B qui conduit, lors de la fixation d'un complexe, à la polyubiquitination de I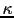 B et son adressage vers le protéasome où elle sera dégradée. Les dimères NF-
B et son adressage vers le protéasome où elle sera dégradée. Les dimères NF-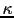 B sont alors transloqués dans le noyau où ils activent la transcription de nombreux gènes NF-
B sont alors transloqués dans le noyau où ils activent la transcription de nombreux gènes NF-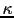 B-dépendants. Des souris transgéniques avec délétion épidermique d'IKK
B-dépendants. Des souris transgéniques avec délétion épidermique d'IKK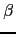 ou d'IKK
ou d'IKK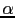 développent dans le premier cas une maladie de la peau inflammatoire et dans le second cas des anomalies de l'épiderme. Cependant, ces modèles montrent de grandes différences avec le psoriasis humain comme l'apoptose des kératinocytes pour les souris mutantes d'IKK
développent dans le premier cas une maladie de la peau inflammatoire et dans le second cas des anomalies de l'épiderme. Cependant, ces modèles montrent de grandes différences avec le psoriasis humain comme l'apoptose des kératinocytes pour les souris mutantes d'IKK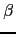 [Gudjonsson et al., 2007].
[Gudjonsson et al., 2007].
De manière générale, les différents modèles murins ne possède qu'une partie des caractéristiques de la maladie, ce qui indique une complexité de celle-ci et l'existence d'interaction entre différents types cellulaires et les cytokines dans la pathogenèse de la maladie.
En résumé, même si les mécanismes physiopathologiques responsables du psoriasis restent encore inconnus, l'existence d'une composante génétique à l'origine de la maladie faisant intervenir plusieurs gènes et d'une composante environnementale est confirmée.



Next: OBJECTIF DE LA THESE
Up: La génétique du psoriasis
Previous: PSORS5
Contents
anouar
2009-08-22
![]() B, du facteur de transcription AP-1, des intégrines, des facteurs de croissance, des interleukines ainsi que des cellules T dans la survenue du psoriasis (Figure 1.15Trois voies de signalisation des modèles murins de psoriasis: STAT3, AP-1 et NF-$$B).
B, du facteur de transcription AP-1, des intégrines, des facteurs de croissance, des interleukines ainsi que des cellules T dans la survenue du psoriasis (Figure 1.15Trois voies de signalisation des modèles murins de psoriasis: STAT3, AP-1 et NF-$$B).

