


Next: Résultats
Up: ANALYSE D'ASSOCIATION: ETUDE DE
Previous: ANALYSE D'ASSOCIATION: ETUDE DE
Contents
De nombreuses régions ont été suggérées comme loci de prédisposition au psoriasis, cependant peu d'entre elles ont été confirmées. Seul le locus HLA est connu comme étant le locus majeur du psoriasis. De plus, peu de gènes ont pu être clairement identifiés comme jouant un rôle dans l'étiologie de cette maladie (Tableau 1.11Gènes et variants associés avec le psoriasis retrouvés dans au moins une étude). Ainsi, une autre approche, l'approche "gènes candidats" est largement utilisée dans le cas des maladies multifactorielles. Elle consiste à choisir un gène candidat en raison de sa fonction, suggérant un rôle dans le processus pathogénique, ou en raison des résultats obtenus dans des modèles animaux ou même d'après les résultats significatifs d'associations de ce gène avec d'autres maladies de pathophysiologies voisines. Ce gène est alors testé par une analyse d'association afin de vérifier s'il constitue bien un facteur de risque pour la maladie étudiée. Cette approche ne dépend donc pas nécessairement de la localisation de ce gène dans un locus d'intérêt, même si cela rend l'implication du gène plus probable.
Parallèlement aux études de liaison, une partie de mon travail de thèse a été de réaliser des études d'association de plusieurs gènes "candidats", non situés dans les régions préalablement identifiées lors du premier criblage dans notre population d'étude. Ce type d'étude est plus puissant que les études de liaison et peut permettre de détecter des gènes à risque relatif faible dits "gènes à faible pénétrance". Le psoriasis est une maladie très complexe qui fait intervenir deux types cellulaires: les kératinocytes et les cellules T. Ne pouvant étudier tous les gènes d'intérêt possibles, le choix des candidats a été restreint à leur rôle dans l'immunité et dans la peau ainsi qu'à leur association avec d'autres maladies auto-immunes ou d'autres maladies de la peau incluant le psoriasis. L'observation d'une pathophysiologie commune entre diverses maladies et la co-occurrence de certaines de ces maladies dans des familles font suggérer l'existence de mécanismes communs y compris génétiques dans le développement de ces maladies. Par exemple, le psoriasis peut survenir avec d'autres maladies inflammatoires telles que l'arthrite psoriasique et la maladie de Crohn [Lee et al., 1990,Gladman, 1994]. Cette constatation est supportée par l'identification de plusieurs loci de prédisposition, communs à différentes maladies auto-immunes et inflammatoires. Par exemple, les loci de prédisposition au psoriasis présent en 1q21, 3q21, 17q25, 20p12 sont aussi liés avec la dermatite atopique (AD), en 5q31 avec la polyarthrite rhumatoïde (RA), AD et l'asthme, en 16q12 avec l'arthrite psoriasique, le lupus érythémateux systémique (SLE) et la maladie de Crohn [Cookson et al., 2001,Yamada and Ymamoto, 2005,Bowcock, 2005,Lee et al., 2007]. De même, l'hypothèse de gènes communs à différentes maladies inflammatoires et auto-immunes est renforcée par de nombreuses études, détaillées ultérieurement. Un gène de prédisposition à l'asthme, ADAM33, a d'ailleurs été montré associé au psoriasis dans notre précédente étude. Les gènes candidats évidents pour une maladie auto-immune et inflammatoire telle que le psoriasis sont les gènes impliqués dans la régulation du système immunitaire et de l'inflammation. Cela implique donc les gènes impliqués dans le développement, la prolifération et l'activation des lymphocytes T comme ceux régulant ou régulés par les facteurs de transcription NF-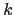 B (PTPN22, CARD15 ou CYLD), RUNX (SLC22A4 ou SLC9A3R1/NAT9) et STAT (STAT3). Les gènes impliqués dans le processus inflammatoire, tels que les gènes codant les cytokines (IL1A, IL1B et IL1RN), ou les récepteurs des cytokines (IL1R1 et IL12RB1), et même ceux impliqués dans le transport de molécules (SLC22A4 et SLC22A5) semblent être de bons candidats. De plus, le psoriasis est une maladie de la peau, caractérisée entre autres par l'hyper-prolifération des cellules épidermiques, les kératinocytes. Ainsi, les candidats potentiels sont également soit les gènes intervenant dans la survie (CYLD), la prolifération (STAT3 et SLC12A8) et la différenciation (c-Jun et JunB) des kératinocytes, soit les gènes intervenant dans la formation de la peau (FLG, TGM1, TGM3, TGM5 et TGM6). Un total de 22 gènes candidats dont certains ont été associés à d'autres maladies ayant des caractéristiques communes avec le psoriasis ont été testés lors de cette étude. L'implication d'un gène commun dans différentes maladies ne signifie pas l'existence d'un même variant causal. Une approche systémique "Tagging SNP" a été entreprise pour tester globalement tous les gènes étudiés (cf explication dans la partie Matériels et Méthodes) [Monpetit and Chagnon, 2006]. De manière générale, après sélection des TagSNPs, nous les testons individuellement et conjointement (haplotype) dans le premier lot de 45 grandes familles atteintes de psoriasis à l'aide du programme FBAT. Lorsqu'une association est suggérée, même faiblement (P<0.08), avec plusieurs des marqueurs, nous tentons de le confirmer avec une réplication méthodologique utilisant les modèles à effets mixtes (Logistic-Normal Models, "LNMs") et également avec une réplication dans un autre lot de 83 familles de même origine [Xu and Shete, 2007]. Contrairement aux analyses par FBAT, la structure familiale est prise en compte dans sa globalité. Pour déterminer si l'association observée lors de la première analyse est indépendante ou non du facteur génétique majeur de risque du psoriasis, l'allèle HLA-Cw6 (PSORS1) ou si de nouvelles associations peuvent être identifiées dans un des deux sous-groupes porteurs ou non de cette allèle à risque, l'association entre le psoriasis et le gène candidat est également testée après la stratification de nos familles selon un haplotype à risque, connu pour être en déséquilibre de liaison avec l'allèle HLA-Cw6 [Asumalahti et al., 2002,Capon et al., 2004a] (cf explication dans la partie Matériels et Méthodes). L'étude de chacun de ces gènes est détaillée par la suite. Une réprésentation détaillée de la structure des gènes ainsi que les TagSNPs analysés sont en annexes.
B (PTPN22, CARD15 ou CYLD), RUNX (SLC22A4 ou SLC9A3R1/NAT9) et STAT (STAT3). Les gènes impliqués dans le processus inflammatoire, tels que les gènes codant les cytokines (IL1A, IL1B et IL1RN), ou les récepteurs des cytokines (IL1R1 et IL12RB1), et même ceux impliqués dans le transport de molécules (SLC22A4 et SLC22A5) semblent être de bons candidats. De plus, le psoriasis est une maladie de la peau, caractérisée entre autres par l'hyper-prolifération des cellules épidermiques, les kératinocytes. Ainsi, les candidats potentiels sont également soit les gènes intervenant dans la survie (CYLD), la prolifération (STAT3 et SLC12A8) et la différenciation (c-Jun et JunB) des kératinocytes, soit les gènes intervenant dans la formation de la peau (FLG, TGM1, TGM3, TGM5 et TGM6). Un total de 22 gènes candidats dont certains ont été associés à d'autres maladies ayant des caractéristiques communes avec le psoriasis ont été testés lors de cette étude. L'implication d'un gène commun dans différentes maladies ne signifie pas l'existence d'un même variant causal. Une approche systémique "Tagging SNP" a été entreprise pour tester globalement tous les gènes étudiés (cf explication dans la partie Matériels et Méthodes) [Monpetit and Chagnon, 2006]. De manière générale, après sélection des TagSNPs, nous les testons individuellement et conjointement (haplotype) dans le premier lot de 45 grandes familles atteintes de psoriasis à l'aide du programme FBAT. Lorsqu'une association est suggérée, même faiblement (P<0.08), avec plusieurs des marqueurs, nous tentons de le confirmer avec une réplication méthodologique utilisant les modèles à effets mixtes (Logistic-Normal Models, "LNMs") et également avec une réplication dans un autre lot de 83 familles de même origine [Xu and Shete, 2007]. Contrairement aux analyses par FBAT, la structure familiale est prise en compte dans sa globalité. Pour déterminer si l'association observée lors de la première analyse est indépendante ou non du facteur génétique majeur de risque du psoriasis, l'allèle HLA-Cw6 (PSORS1) ou si de nouvelles associations peuvent être identifiées dans un des deux sous-groupes porteurs ou non de cette allèle à risque, l'association entre le psoriasis et le gène candidat est également testée après la stratification de nos familles selon un haplotype à risque, connu pour être en déséquilibre de liaison avec l'allèle HLA-Cw6 [Asumalahti et al., 2002,Capon et al., 2004a] (cf explication dans la partie Matériels et Méthodes). L'étude de chacun de ces gènes est détaillée par la suite. Une réprésentation détaillée de la structure des gènes ainsi que les TagSNPs analysés sont en annexes.
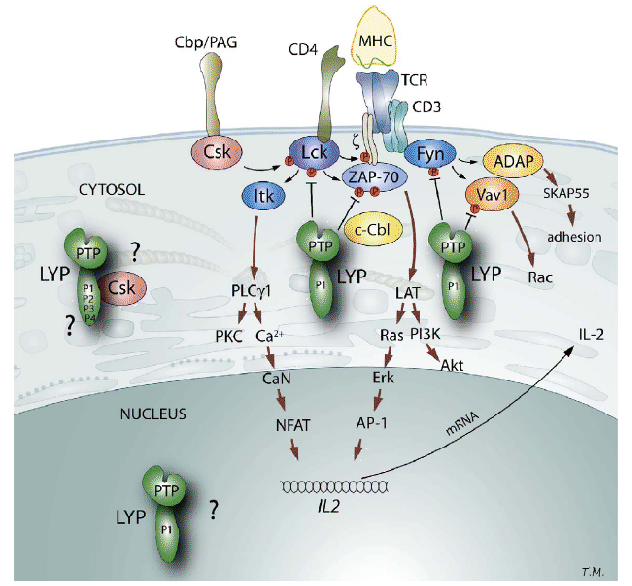
Figure 3.2:
Représentation schématique des fonctions connues et putatives de PTPN22 dans la voie de signalisation du récepteur de surface des lymphocytes T (TCR)
La protéine Lyp intervient en aval de la voie de signalisation TCR. Seule ou sous forme de complexe avec d'autres protéines (Csk ou c-Cbl), elle inhibe certaines protéines kinases, initiatrices du signal TCR telles que Lck et Fyn pour permettre la régulation négative des lymphocytes T activés. Le variant R620W, associé à de nombreuses maladies auto-immunes, est situé dans le domaine de liaison entre les protéines Lyp et Csk. In vitro, la protéine Lyp possédant un tryptophane à ce site perd sa capacité à lier Csk. Cette absence de fixation entraîne une dérégulation de l'activation des cellules T pouvant amener à des phénomènes d'auto-immunité.
Les flèches indiquent les événements régulateurs positifs et les lignes en T indiquent les événements inhibiteurs (comme la déphosphorylation). (D'après [Bottini et al., 2006])
 |



Next: Résultats
Up: ANALYSE D'ASSOCIATION: ETUDE DE
Previous: ANALYSE D'ASSOCIATION: ETUDE DE
Contents
anouar
2009-08-22

